
حتما تا به حال شناور ماندن روغن بر روی آب را دیده اید، نظیر این حالت را شاید در لامپ های لاوا که در آن یک مایع رنگی به بالا و پاین حرکت می کند، دیده باشید.
این لامپ ها از دو مایع مخلوط نشده با چگالی متفاوت تشکیل شده اند. پس به نظر می آید که در این گونه موارد، ماده حل شونده، غیر قابل حل در حلال است؛ یعنی به بیان شیمیایی، انحلال پذیری آن تقریبا صفر است. برای همین است که هیچ کدام از مواد لامپ با هم ترکیب نمی شوند.
انحلال پذیری از درجه"غیر قابل انحلال" مانند لامپ لاوا تا درجه"بسیارقابل انحلال" مانند نمک در آب تقسیم می شود.
میزان انحلال پذیری یک ماده حل شونده در یک حلال به طور قابل توجهی به ماهیت و قدرت نیروهای جاذبه بین ذرات حل شونده - حل شونده ، حلال - حلال و حل شده - حلال بستگی دارد. بیشترین انحلال وقتی مشاهده میشود که این نیروها همانند باشند، یعنی نخستین قاعده انحلال پذیری این است که "نظیر در نظیر حل می شود." بطور کلی ، مواد قطبی فقط در حلالهای قطبی و مواد ناقطبی فقط در حلالهای ناقطبی حل میشوند. یعنی مواد ناقطبی و مواد قطبی معمولا امتزاج ناپذیرند.
اصطلاحاتی که در بحث انحلال مهم هستند:
هنگامی که ماده ای مانند نمک را در آب حل می کنیم، آب در نقش حلال، نمک در نقش ماده حل شونده و ترکیب آب و نمکی که در آن حل شده است، محلول نامیده می شود.

انحلال پذیری(به انگلیسی: Solubility) مفهومی بنیادی در علم شیمی و مبحث محلولهااست که میزان حل شدن یک ماده (جامد،مایع یا گاز) را در یک حلال مشخص (جامد، مایع یا گاز) بیان میکند. این کمیت با عواملی چون نوع حلال،دما و فشار رابطه دارد. محلولی که به اندازه انحلال پذیری خود در دما و فشار مشخص، مادهای را در خود حل کرده باشد، محلول اشباع گوییم و در صورتی که بیش از این مقدار ماده در محلول حل شود، محلول را فوق اشباع مینامیم. معمولاً انحلال پذیری مواد مختلف را به صورت گراف نسبت به عوامل دیگری چون دما و فشار نمایش میدهند.
انحلال پذیری یک ماده حل شونده، غلظت محلول اشباع شده آن است.
محلول اشباع: محلولی است که بالاترین مقدار از ماده حل شونده در حلال در یک دمای مشخص در آن حل شده است و آهنگ انحلال با آهنگ رسوب آن با هم برابر است.
محلول غیر اشباع: محلولی است که ماده حل شونده به طور کامل در حلال، حل شده است.
محلول فوق اشباع: محلولی است که مقدار ماده حل شده از بالاترین حد انحلال، خیلی بیش تر است. در این حالت، مقداری از ماده حل شونده به صورت حل نشده ممکن است باقی بماند.
اصل لوشاتلیه: این اصل بیان می کند هنگامی که یک سیستم را از تعادل شیمیایی خارج کنیم، سیستم خود را به حالتی پیش خواهد برد که اثر تغییرات داده شده را تا حد ممکن کم کند.
واکنش گرماگیر: واکنشی که در آن گرما جذب می شود( ΔH>0 ).
واکنش گرمازا: واکنشی که در آن گرما آزاد می شود( ΔH < 0 ).
فرایند انحلال:
میان مولکولهای کووالانسی ناقطبی ، تنها نیروهای بین مولکولی موجود ، نیروی لاندن است. ولی نیروهای جاذبه بین مولکولهای کووالانسی قطبی علاوه بر نیروهای لاندن ، نیروهای دو قطبی - دو قطبی را نیز شامل میشود. در مواردی که پیوند هیدروژنی وجود دارد، نیروهای بین مولکولی بطور غیر عادی قوی است. از آنجایی که مواد ناقطبی فقط در حلالهای ناقطبی حل میشوند، ید که یک ماده ناقطبی است، در تتراکلریدکربن حل میشود.
نیروی جاذبه بین مولکولهای I2 در ید جامد ، تقریبا از همان نوع و اندازهای است که بین مولکولهای CCl4 در تتراکلریدکربن خالص وجود دارد و از این رو، جاذبه ای قابل توجه بین ید و تتراکلرید کربن ممکن میگردد و مولکولهای ید میتوانند با مولکولهای تتراکلریدکربن ممزوج شوند و محلول حاصل یک مخلوط مولکولی بی نظم است. متیل الکل (CH3OH) و آب (هر دو ماده قطبی) به هر نسبت در یکدیگر حل میشوند. در محلول متیل الکل و آب ، مولکولهای CH3OH و H2O با پیوند هیدروژنی به هم پیوستهاند که در حالت مایع خالص نیز مولکولهای هر دو مایع بوسیله پیوند هیدروژنی به یکدیگر جذب میشوند.
مایعات قطبی (بویژه آب) میتوانند حلال بسیاری از ترکیبات یونی باشند. یونهای مواد حل شده توسط مولکولهای قطبی با نیروی الکتروستاتیکی جذب میشوند، یعنی یونهای منفی توسط قطبهای مثبت مولکولهای حلال و یونهای مثبت توسط قطبهای منفی این مولکولها جذب میشوند. این جاذبه یون - دو قطبی ممکن است نیروهای نسبتا قوی باشند و موجب میشود که یونها از بلور جدا شده و در فاز مایع شناور شوند. یونهای حل شده آبپوشیدهاند و در حالی که با غلافی از مولکولهای آب احاطه شدهاند در محلول حرکت میکند.
انحلال پذیری:
تعریف: انحلال پذیری به صورت بالاترین مقداری که ماده حل شونده می تواند در مقدار مشخصی از حلال در حالت تعادل، حل شود؛ تعریف می شود.
در چنین تعادلی، می توان از اصل لوشاتلیه استفاده کرد تا عوامل تأثیرگذار بر انحلال پذیری را بهتر توضیح داد. البته توجه داشته باشید که انحلال یک فرایند فیزیکی است (یعنی تغییر در حالت شیمیایی مواد به وجود نمی آید) و مقدار آن می تواند اندازه گیری شود.
عوامل مۆثر بر انحلال پذیری:
انحلال پذیری
رابطه ماده حل شونده – حلال: جاذبه قوی حلال و ماده حل شونده، باعث انحلال پذیری بیش تر می شود. به همین ترتیب اگر جاذبه کمی بین مولکول های حلال و ماده حل شونده وجود داشته باشد، به همان نسبت، انحلال پذیری کم تر خواهد بود. برای فهم بهتر این مطلب به مطلب "حالت های ترکیبات یونی" نیز مراجعه کنید.
مواد قطبی در حلال های قطبی بهترحل می شوند. در حالی که مواد غیر قطبی در مواد غیرقطبی بهتر حل می شوند. حل شدن یک ماده قطبی در حلال غیر قطبی (یا برعکس آن) به صورت غیر قابل انحلال است و یا به مقدار بسیار جزئی انحلال وجود دارد.
این قانون را همواره به یاد داشته باشید: مواد مشابه همدیگر را حل می کنند.
اثر یون مشترک:
این اثر بیان می کند که وقتی به سیستم در حال تعادل شیمیایی، نمکی اضافه می شود که دارای همان یون موجود در محلول تعادلی است، انحلال پذیری ترکیب یونی کاهش پیدا می کند.
با یک مثال این مطلب را بهتر متوجه خواهید شد:
در یک آزمایش، یک ترکیب یونی که انحلال پذیری کمی دارد مانند CaSO4 به آب اضافه می کنیم. معادله یونی خالص برای تعادل شیمیایی نهایی به صورت زیر خواهد بود:

سولفات کلسیم انحلال پذیری کمی دارد؛ به این معنا که در حالت تعادل، بیش تر کلسیم و سولفات ها در حالت جامد سولفات کلسیم قرار دارند و کاملا حل نشده اند.
حال اگر ترکیب یونی انحلال پذیر سولفات مس (CuSO4) را به محلول قبلی اضافه کنیم؛ تنها اثر مهم این ماده انحلال پذیر روی معادله یونی خالص، افزایش دادن یون های سولفات SO4- است.
یون های سولفات جدا شده از سولفات مس در حالت دوم در ترکیب مختصر تجزیه شده سولفات کلسیم نیز وجود داشتند. بنابراین این افزایش در یون های سولفات، باعث یک تغییر در سیستم تعادلی قبلی می شود. اصل لوشاتلیه نیز می گوید اگر تغییری به سمت محصولات یک واکنش تعادلی وارد شود، معادله برای کاهش اثر این تغییرات به سمت واکنش دهنده ها باید پیش رود. در این حالت که معادله به سمت واکنش دهنده ها پیشرفت می کند، طبق معادله بالا می بینیم که انحلال پذیری کم سولفات کلسیم خیلی بیش تر کاهش می یابد.
عوامل موثر بر انحلال پذیری
در مطلب قبل خواندید که انحلال پذیری یعنی چه و تعدادی از عوامل موثر بر آن را نیز مطالعه کردید؛ در این مطلب می خواهیم به ادامه عوامل مهم و موثر در انحلال یعنی اثر دما و فشار بر انحلال پذیری مواد جامد، مایع و گاز بپردازیم.
دما:
تغییرات دما حتما روی انحلال پذیری مواد جامد، مایع و گاز تأثیر می گذارد. البته این اثرات فقط به طور محدود برای گازها و جامدات تعیین شده اند.
مواد جامد:
اثر دما روی مواد جامد، بسته به این که واکنش گرماگیر است یا گرمازا، فرق می کند. با استفاده از اصل لوشاتلیه می توانیم اثر دما روی هر دو واکنش را معین کنیم.
در یک واکنش گرماگیر (که گرما روی طرف واکنش دهنده هایی که جامدند، اعمال می شود)، افزایش دما تغییری روی طرف واکنش دهنده ها ایجاد می کند؛ طبق اصل لوشاتلیه برای تعادل دوباره، معادله به سمت طرف محصولات پیش می رود. با این کار، ماده جامد بیش تر تجزیه می شود و تعادل جدیدی حاصل می شود که در آن انحلال پذیری جامد افزایش یافته است.
در واکنش گرمازا (که گرما به قسمت محصولات واکنش که همان یون های تجزیه شده مواد جامد واکنش دهنده هستند، اعمال می شود)، افزایش دما در قسمت محصولات، یک تغییر در حالت تعادلی واکنش ایجاد می کند، طبق اصل لوشاتلیه واکنش به سمت واکنش دهنده ها پیش می رود. با این جابجایی و تعادل جدید، مقدار کمی از مواد جامد واکنش دهنده تجزیه می شوند و انحلال پذیری کاهش پیدا می کند.
مایعات:
تغییرات دما، هیچ رفتار مشخصی روی انحلال پذیری مایعات ندارد. شاید هیچ گاه ترکیب حلال – حل شونده ای که هر دو به صورت مایع هستند، با مشکل مواجه نشود.
گازها:
در مورد مواد، نخست به یاد داشته باشد که دما، مقیاس و میزانی از انرژی جنبشی متوسط ماده را نشان می دهد. وقتی دما افزایش پیدا می کند، حرکت مولکول های گاز بیش تر شده و بنابراین احتمال این که ذرات گاز حل شده در مایع، به فاز گازی فرار کنند بیش تر می شود و ذرات گاز موجود، کم تر حل می شوند.
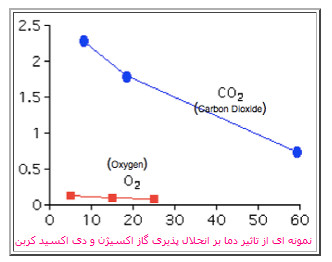
طبق اصل لوشاتلیه، این رفتار گازها را بهتر می توان فهمید. ابتدا دقت کنید که حل شدن گاز در مایع معمولا گرمازا است؛ بنابراین افزایش دمای اعمال شده به سمت محصولات این واکنش، یک تغییر در سیستم به وجود می آورد. پس سیستم به سمت واکنش دهنده ها پیش می رود تا این تغییر را کم تر کند. در نتیجه، غلظت تعادلی ذرات گاز در فاز گازی افزایش پیدا خواهد کرد و انحلال پذیری گاز، کم تر خواهد شد. برعکس این حالت نیز برای کاهش دما در سمت محصولات برای گاز اتفاق می افتد. یعنی کاهش دما طبق اصل لوشاتلیه باعث افزایش انحلال پذیری گاز می شود.
فشار:
اثر فشار بر روی انحلال پذیری مواد جامد و مایع بسیار کوچک است؛ بنابراین از اثر فشار بر روی گازها صحبت خواهیم کرد:
در مورد گازها با ترکیب اصل لوشاتلیه و قانون هنری می توان اثر فشار را روی انحلال پذیری آن ها بررسی کرد. قانون هنری بیان می کند هنگامی که دما ثابت است، انحلال پذیری گاز با فشار جزئی آن متناسب است:

که p فشار جزئی گاز موجود در بالای مایع است، kh ثابت هنری و c غلظت گاز در مایع است.
در دمای ثابت، از این فرمول می توان نتیجه گرفت؛ زمانی که فشار جزئی کاهش پیدا می کند، غلظت گاز در مایع نیز کاهش پیدا خواهد کرد و این به معنای کاهش انحلال پذیری نیز هست و برعکس.
سیستمی را در نظر بگیرید که در آن مقداری گاز در مایع حل شده است. افزایش فشار باعث افزایش فشار جزئی (فشار وارد بر هر قسمت از این ترکیب) می شود و گاز بیش تر متراکم می شود. افزایش فشار جزئی به این معناست که ذرات گازی بیش تری وارد مایع می شوند (گاز بالای مایع در این حالت، کم تر می شود) و فشار جزئی نیز با این تغییر، کاهش پیدا می کند؛ یعنی برای کم کردن اثر این تغییر در افزایش فشار، واکنش خود را به گونه ای تغییر می دهد که انحلال پذیری بیش تر شود.
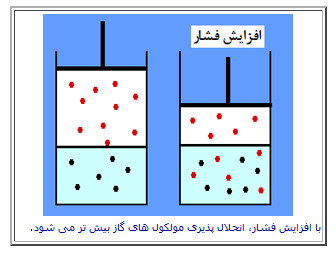
اگر در همین حالت، فشار وارد بر سیستم را کاهش می دادیم، مولکول های گازی بیش تری از مایع فرار می کردند و برای همین انحلال پذیری کم تر می شد.
برای مشاهده فیلم مربوط به انحلال پذیری و آهنگ واکنش این جا را کلیک کنید.
برای فهم مطالب بالا بهتر است این واکنش تعادلی را با هم بررسی کنیم:
انحلال پذیری دی اکسید کربن با تغییرات زیر چه تغییری می کند؟
الف) دما افزایش پیدا کند.
ب) فشار و دما افزایش پیدا کنند.
ج) فشار، افزایش ولی دما کاهش پیدا کند.
د) فشار کاهش پیدا کند.
جواب:
الف) واکنش گرما زا است؛ بنابراین افزایش در دما به معنای کاهش انحلال پذیری است.
ب) افزایش در هر دو عامل فشار و دما در این واکنش به معنای انحلال پذیری بیش تر است.
ج) با اطلاعات داده شده، نمی توان فهمید انحلال پذیری چه تغییری می کند.
د) افزایش در فشار، باعث وارد شدن مولکول های گازی بیش تری به مایع می شود تا فشار جزئی را کاهش دهد؛ بنابراین انحلال پذیری افزایش پیدا می کند.
تعادلهای انحلال:
تعادل مایع - مایع (حل شدن برم در آب)
هر گاه 50 گرم برم را که مایعی است قرمز رنگ ، فرار و سمی در ظرف محتوی یک لیتر آب بریزیم، دو لایه قرمز و بی رنگ پدید میآید. با گذشت زمان برم در آب حل میشود و محلول کم کم پر رنگ میشود و بالاخره تغییر متوقف میشود. گر چه مایع برم هنوز در ته ظرف وجود دارد (در حدود 14 گرم). در این شرایط که محلول برم در مجاورت برم خالص قرار دارد و هیچگونه تغییری مشهود نیست، میگوییم سیستم در حال تعادل است. ویژگی مهم تعادل ، تغییر ناپذیری خواص ماکروسکوپی آن است. خواص ماکروسکوپی ، خواصی است که به مقدار زیادی از ماده وابسته است به اندازهای که قابل مشاهده و اندازه گیری باشد و تغییرات آنها آشکار شود.
تعادل جامد - مایع (حل شدن نمک طعام در آب)
هر گاه مقداری زیادی بلورهای نمک طعام (در حدود 500 گرم) را به یک لیتر آب بیفزاییم و مخلوط را بهم بزنیم چون هم زدن را تا 10 دقیقه ادامه دهیم، خواهیم دید که مقدار زیاد نمک حل میشود و فقط 140 گرم آن باقی میماند که با بهم زدن زیاد هم از وزن نمک موجود در ته ظرف کاسته نمیشود. بنابراین میگوییم که به حالت ثابتی رسیده و سیستم در حال تعادل است، زیرا خواص ماکروسکوپی آن تغییر نمی کند. در حقیقت پدیده تعادل در سیستم جامد - مایع آب نمک شامل دو فرآیند است که در حال رقابت با یکدیگرند.
در ابتدا که نمک را در آب ریختیم، فرآیند حل شدن که شامل یونیزه شدن NaCl به کاتیونهای سدیم و آنیونهای کلر است، اغلب در یک جهت معینی از بلور به سوی محلول انجام میگیرد. با پیشرفت فرآیند حل شدن و افزایش غلظت یونها در محلول ، واکنش معکوس نیز امکان پذیر میشود. یعنی افزوده شدن یونهای محلول به بلور (تبلور یا رسوب کردن) انجام میشود. مادام که موازنه این دو فرایند برقرار است، مقدار نمک حل شده در واحد حجم محلول ثابت خواهد بود و سیستم در تعادل انحلال پذیری باقی خواهد ماند.
تعادل گاز- مایع (حل شدن گاز CO2 در آب)
انحلال گازها در مایعات با دما نسبت عکس و با فشار نسبت مستقیم دارد. مکانیسم حل شدن گاز در مایع ، کم و بیش مشابه حل شدن جامد در مایع و مایع در مایع است. هر گاه بوسیله یک لوله گاز دیاکسید کربن را در آب موجود در یک ظرف بدمیم، حبابهای درشت گاز که وارد آب میشوند، بتدریج کوچک شده و حتی ممکن است ناپدید شوند و این نشانه حل شدن جزئی آنهاست. با ادامه دمیدن ، به مرحلهای میرسیم که آب بوسیله گاز سیر میشود و دیگر حبابهای گاز بدون کاهش حجم خارج میشوند. در این شرایط در دما و فشار هوای اطاق ، غلظت گاز در آب ثابت میماند و به عبارتی تعادل زیر برقرار میشود:
(محلول) CO2 (گاز)
