
مقدمه
اوربیتال محدودهای از فضای اطراف هسته میباشد که احتمال یافتن الکترون در آن وجود دارد. این احتمال در نزدیکی هسته بیشترین مقدار را دارد. ولی برای تمام نقاطی از فضا که فاصله معینی از هسته دارند، احتمال معینی وجود دارد. هر اوربیتال میتواند حداکثر دو الکترون را در خود جای دهد. دو الکترونی که در یک اوربیتال جای میگیرند، دارای اسپین مخالف هستند.
هر الکترون را میتوان با چهار عدد کوانتومی مشخص کرد که به منزله شناسنامه الکترون هستند و فاصله نسبی الکترون از هسته (n) ، لایه فرعی و شکل اوربیتال (L) ، جهت گیری اوربیتال در فضا (s) را بیان میکنند. بر اساس اصل طرد پاولی در یک اتم هیچ دو الکترونی را نمیتوان یافت که تمام چهار عدد کوانتومی آنها یکسان باشد.
تاریخچه
در مورد ساختمان اتم و نحوه قرار گرفتن الکترونها و پروتونها در آن بررسیهای زیادی توسط دانشمندان انجام شده و نظریههای مختلفی ارائه شده است. تامسون اتم را به شکل کرهای یکنواخت از بارهای مثبت تا شعاع تصور میکرد که بارهای منفی در محیط خارجی کره پراکندهاند. رادرفورد در سال 1911 با استفاده از ذرات آلفا دلایل قانع کنندهای مبنی بر وجود هسته اتم ارائه داد. او اتم را بصورت کره ای تصور میکرد که هسته در وسط آن قرار دارد و الکترونها به فواصل نسبی بینهایت زیاد در خارج از هسته قرار دارند. نیلز بوهر در سال 1913 نظریه ساختمان الکترونی اتم را پیشنهاد کرد.
این نظریه بر اساس مدل اتمی رادرفورد ، نظریه کوانتومی پلانک و دادههای تجربی حاصل از مطالعه طیفهای اتمی قرار داشت، و بیان میکرد که الکترون اتم هیدروژن فقط میتواند در مدارهای کروی معین (مدارها یا ترازهای انرژی) که بطور متحدالمرکز دور هسته قرار دارند، وجود داشته باشد. این مدارها تابع محدودیت کوانتومی است. شرودینگر در سال 1926 با طرح معادلهای که در آن محدودیت کوانتومی انرژی الکترون و تصور الکترون بصورت موج ساکن ، با هم تلفیق شده بود، تابع موجی الکترون (ψ) را معرفی کرد که مختصات مکان الکترون در فضایی که الکترون در آن یافت میشود و انرژی الکترون از لحاظ ریاضی را به هم مربوط کرد.
اگر الکترون را بصورت ذرهای در حال حرکت به دور هسته در نظر بگیریم، ψ2 متناسب با احتمال یافتن الکترون در جزو معینی از فضاست و احتمال یافتن الکترون در ناحیهای که ابر الکترونی غلیظتر باشد بیشتر است.
اوربیتال اتمی تابع ریاضی است که رفتار موجی مانند یک الکترون و یا یک جفت الکترون در اتم را توضیح میدهد.. این تابع را میتوان به منظور محاسبهٔ احتمال حضور الکترون در یک اتم در مناطق خاصی در اطراف هسته مورد استفاده قرار داد. از عملکرد این تابع میتواند در ترسیم نمودار سه بعدی از احتمال حضور الکترون در یک مکان استفاده کرد که این منطقهٔ فیزیکی با احتمال زیاد تعیین میشود. به طور خاص، اوربیتالهای اتمی ممکن در ویژه حالتی از یک تک الکترون که در مجموعهای از الکترونها در اطراف اتم منفرد قرار دارند با تابع اوربیتال توضیح داد.
اوربیتال اتمی که در آن الکترون به عنوان ذرات جامد است را هرگز نمیتوان با سیارهٔ که بصورت بیضوی به دور خورشید میگردد توضیح داد.
با یک مقایسه دقیق ممکن است چنین به نظر برسد که الکترونی که درجو اطراف هسته قرار دارد مانند جو یک سیارهاست. اوربیتال اتمی نحوه شکل گیری این جو را فقط به یک الکترون منفرد در یک اتم را توضیح میدهد. وقتی که الکترونهای بیشتری به اتم منفرد اضافه میشود این الکترونها تمایل دارند بطور مساوی در حجم فضای اطراف هسته قرار بگیرند (که گاهی به این ابر الکترونی) گفته میشود
این ایده که الکترون ممکن است در اطراف هسته با چرخشی که به آن تکانهٔ زاویهای می گویند در سال ۱۹۱۳ توسط نیلز بور استدلال شد. و یک فیزیکدان ژاپنی به نام (Hantaro Nagaoka) در اوایل سال ۱۹۰۴ فرضیه مبتنی به رفتارهای الکترونیکی به این مورد را منتشر کرد.. با این حال تا سال ۱۹۲۶ معادله شرودینگر برای حل حرکت موجی الکترون در اتم برای توابع اوربیتال جدید آماده نبود..[
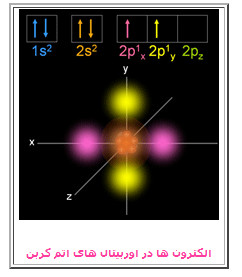
با توجه به تفاوت مدارمکانیک کلاسیک از واژه «مدار» برای الکترون در اتم، برای اولین بارشیمیدانی بنام رابرت میلیکان در سال ۱۹۳۲ اصطلاح اوربیتال را ابداع و جایگزین آن کرد.. اوربیتال اتمی، معمولاً به عنوان توصیف هیدروژنگونه (به معنی یک الکترون) برای تابع موج در فضا است، اعداد کوانتومی که بصورت n، l و m دسته بندی میشوند متناظر هستند با جفت الکترون انرژی، که تکانه زاویهای و تکانه زاویهای مسیر از آن به دست میآیند. هر اوربیتال (توسط یک مجموعه از اعداد کوانتومی متفاوت تعریف میشود) که دارای حداکثر دو الکترون است، از نامهای کلاسیک در آرایش الکترونی نشان داده شده در تصویر سمت چپ نیزاستفاده شدهاست. نامهای اوربیتال کلاسیک که با (s، p، d، f) نشان داده میشوند از ویژگیهای خطوط طیفی آنها مشتق شدهاست.
از حدود سال ۱۹۲۰، یا حتی قبل از ظهور مکانیک کوانتومی مدرن، اصل آفبا (اصل ساخت و ساز) است که در آن اتمها متشکل از جفت الکترونهای هستند، که از تکرار یک الگوی ساده و منظم که با افزایش اعداد فرد (.. ۱، ۳، ۵، ۷) است پیروی میکنند، توسط نیلز بور و دیگران که برای پی بردن به وجود چیزی شبیه به اوربیتال اتمی، در داخل تعدادی از ساختار الکترونی اتمهای پیچیده مورد استفاده قرار گرفته بود. در ریاضیات فیزیک اتمی، برای ساده کردن تابع موج الکترون در سیستمهای پیچیده اغلب مناسب از ترکیبات ساده تر اوربیتال اتمی استفاده شود. اگرچه هر الکترون را نمیتوان در یک اتم چند الکترونی که یکی را از یک یا دوالکترون ازاوربیتال اتمی در یک تصویر خیالی محدود کرد، هنوز هم تابع موج الکترون ممکن است ترکیباتی از اوربیتال اتمی را دربر داشته باشد؛ مثل اینکه، در بعضی مواقع ابر الکترونی یک اتم چند الکترونی هنوز هم با اوربیتال اتمی متشکل از تنها یک یا دو الکترون باشد.
شاید فکر کنید اتم مانند یک هرم معکوس، عجیب و غریب است و هسته آن در پایین ترین طبقه هرم قرار دارد و اتاق های مختلفی (اوربیتال ها) در بالاترین طبقه های هرم با الکترون ها اشغال شده اند.
در طبقه اول تنها یک اتاق وجود دارد (اوربیتال 1s)، در طبقه دوم، 4 اتاق وجود دارد (اوربیتال های 2s، 2px، 2py و 2pz)؛ در طبقه سوم، 9 اتاق (یک اوربیتال 3s، سه اوربیتال 3p و پنج اوربیتال 3d) و ... .
اما این اتاق ها خیلی بزرگ نیستند..... هر اوربیتال تنها می تواند دو الکترون را در خود جای دهد.
اعداد کوانتومی
مکانیک موجی که نظریه شرودینگر اساس آن میباشد با استفاده از چهار عدد کوانتومی وضعیت الکترون را توصیف میکند. این اعداد عبارتند از :
عدد کوانتومی اصلی
این عدد نشاندهنده ترازهای انرژی است که الکترونها در آن ترازها به دور هسته گردش میکنند و عدد صحیحی میباشد. این عدد میتواند کلیه مقادیر اعداد صحیح مثبت به استثنای صفر را قبول کند.
عدد کوانتومی اندازه حرکت زاویهای مداری
آرنولد زمر فیلد در سال 1916 پیشنهاد کرد که هر مدار بوهر (n) با شرط n>1 از لایههایی فرعی با اختلاف انرژی کم تشکیل شدهاست. به هر لایه فرعی یک عدد کوانتومی (L) نسبت داده میشود. این عدد نشان دهنده شکل هندسی توزیع تابع احتمال پیدا کردن الکترون در فضای اطراف هسته میباشد وکلیه مقادیر L=0,1,2, … , n-1 را اختیار کند.
عدد کوانتومی مغناطیسی مداری
تعداد اوربیتالهای یک تراز فرعی را میتوان از این عدد استنتاج کرد که در اثر میدان مغناطیسی هر تراز L به این ترازها شکافته میشود. بعنوان مثال میدان مغناطیسی بر اوربیتال کروی S که با عدد L=0 مشخص میشود، تاثیری ندارد چون S تقارن کروی دارد و در تمام جهتها بطور یکسان تحت تاثیر خطوط نیرو قرار میگیرد. این عدد که با m نشان داده می شود، مقادیر ممکن این عدد عبارتند از :
m=+L,…,0,…,-L
یک روش مناسب نشان دادن اوربیتال این است که الکترون ها را در جعبه ای تصور کنیم!
الکترون ها در جعبه:
می توان اوربیتال ها را به صورت جعبه هایی نشان داد و الکترون های درون آن ها را با فلش هایی نشان داد. معمولا از فلش رو به بالا و رو به پایین برای نشان دادن جهت مختلف الکترون ها استفاده می شود.
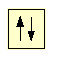
یک اوربیتال 1s، دو الکترون را به صورت شکل مقابل در خود جا می دهد؛ که می توان آن را به صورت 1s2 نیز نوشت که نباید به صورت 1s به توان 2 بخوانید!
چیدن الکترون ها در اوربیتال ها
نباید دو عدد این نوع نشان دادن الکترون در اوربیتال را فراموش کنید:

ترتیب پر شدن اوربیتال ها:
قبل از این که الکترون ها اوربیتال های پر انرژی را پر کنند، اوربیتال های کم انرژی (نزدیک تر به هسته) را پر می کنند؛ اگر دو اوربیتال، انرژی یکسانی داشته باشند، تا حد ممکن به صورت جدا جدا اوربیتال ها را پر می کنند.
پر شدن تک تک اوربیتال ها تا آخرین ظرفیتشان، قاعده هوند نام دارد و در مورد اوربیتال هایی که انرژی دقیقا یکسانی دارند (مثلا سه اوربیتال p) به کار می رود و کمک می کند که دافعه بین الکترون ها به کم ترین میزان خود برسد؛ برای همین اتم را پایدار می سازد.
شکل زیر انرژی اوربیتال ها تا تراز 4 انرژی (البته نه با مقیاس درست) را نشان می دهد:
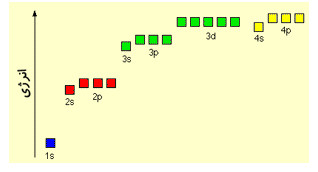
توجه کنید که اوربیتال s همیشه کمی از اوربیتال p در همان تراز انرژی، پایین تر است؛ برای همین اوربیتال s همیشه قبل از اوربیتال p پر می شود.
اما مکان اوربیتال های 3d عجیب است. این اوربیتال ها کمی بالاتر از تراز 4s هستند اما اوربیتال 4s قبل از آن ها پر می شود و بعد اوربیتال های 3d و 4p پر می شوند. چنین اتفاقی در ترازهای بالاتر انرژی هم تکرار می شود؛ زیرا تراز های انرژی با هم هم پوشانی می کنند و به عنوان مثال، اوربیتال 4f بعد از پر شدن 6s پر می شود.
